Asam amino
Asam Amino
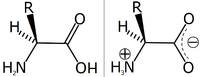
Struktur asam amino alfa dalam bentuk yang tidak terionisasi
Asam amino adalah senyawa organik yang memiliki gugus fungsi karboksil (–COOH) dan amina (biasanya –NH2), serta rantai samping (gugus R) yang spesifik untuk setiap jenis asam amino.[1] Dalam biokimia sering kali pengertiannya dipersempit: gugus karboksil dan amina terikat pada satu atom karbon (C) yang sama (disebut karbon alfa atau karbon-α). Dalam kasus ini, mereka dikenal sebagai asam amino-α atau asam amino-alfa (rumus umumnya H2NCHRCOOH, kecuali pada prolina[a]). Gugus karboksil disebut asam amino proteinogenik. Gugus R dari asam amino polar lebih larut dalam air, atau lebih hidrofilik, dibandingkan dengan asam amino nonpolar, karena golongan ini mengandung gugus fungsional yang membentuk ikatan hidrogen dengan air.
Asam amino mempunyai 2 gugus kimia penyusun yang saling berlawanan sifat yaitu gugus amina ( -NH2) yang bersifat basa dan gugus karboksil ( -COOH) yang bersifat asam. Akibat adanya dua gugus ini, maka asam amino dapat bereaksi baik dengan asam maupun basa. Sifat ini disebut amfoter. Asam amino dalam bentuk ion dipolar dapat bersifat asam (donor proton) atau basa (akseptor proton) bergantung dengan siapa asam amino tersebut bereaksi. Sifat ini disebut sifat amfoter.
Asam amino-asam amino ini bergabung melalui ikatan peptida membentuk molekul besar yang disebut peptida, polipeptida, hingga protein. Ikatan peptida merupakan ikatan yang terbentuk ketika atom karbon pada gugus karboksil suatu molekul berbagi elektron dengan atom nitrogen pada gugus amina molekul lainnya. ikatan peptida hanya terdapat pada protein. Ikatan peptida adalah ikatan kovalen yang terbentuk antara dua molekul asam amino ketika gugus karboksil asam amino bereaksi dengan gugus amina dari asam amino yang lain dengan melepaskan molekul air. Satu molekul protein dapat terdiri dari 12 sampai 20 macam asam amino; dan jumlah setiap macam asam amino tersebut dapat mencapai ratusan buah. Setiap macam asam amino dihubungkan dengan ikatan peptida membentuk peptida. Karena jumlah peptida tersebut sangat banyak maka protein sering kali disebut sebagai polipeptida. Adapun ikatan-ikatan yang terlibat dalam penyusunan struktur protein meliputi: ikatan peptida, ikatan disulfida, ikatan hidrogen, serta ikatan elektrostati.
Adanya gugus amino dan karboksil bebas pada ujung-ujung rantai molekul protein, menyebabkan protein mempunyai banyak muatan dan bersifat amfoter (dapat bereaksi dengan asam maupun basa).
Selain berperan sebagai residu dalam protein, asam amino (baik proteinogenik maupun nonproteinogenik) juga berpartisipasi dalam sejumlah proses biologis misalnya glutamat (asam glutamat standar) dan asam gamma-aminobutirat (GABA) yang berperan sebagai neurotransmiter.
Sembilan asam amino proteinogenik disebut "esensial" bagi manusia karena tidak bisa diproduksi oleh tubuh manusia dari senyawa lain sehingga harus diperoleh dari makanan. Asam amino lainnya mungkin bersifat esensial dalam kondisi tertentu, misalnya untuk usia atau kondisi medis tertentu. Asam amino esensial juga dapat berbeda-beda di antara spesies.[b] Karena signifikansi biologisnya, asam amino penting dalam nutrisi dan biasanya digunakan dalam suplemen nutrisi, pupuk, pakan, dan teknologi makanan. Penggunaan asam amino dalam industri misalnya produksi obat-obatan, plastik terdegradasi biologis, dan katalis kiral.
Sejarah
Beberapa asam amino pertama ditemukan pada awal abad ke-19.[2][3] Pada tahun 1806, ahli kimia Prancis Louis-Nicolas Vauquelin dan Pierre Jean Robiquet mengisolasi senyawa dalam asparagus yang kemudian dinamai asparagina, asam amino pertama yang ditemukan.[4][5] Sistin ditemukan pada tahun 1810,[6] meskipun monomernya, sistein, tetap tidak ditemukan hingga tahun 1884.[5][7] Glisina dan leusina ditemukan pada tahun 1820.[8] Treonina adalah jenis terakhir dari 20 asam amino umum yang ditemukan pada tahun 1935 oleh William Cumming Rose, yang juga menentukan asam amino esensial dan menetapkan kebutuhan harian minimum dari semua asam amino untuk pertumbuhan yang optimal.[9][10]
Kesatuan kategori kimia diusulkan oleh Wurtz pada tahun 1865, tetapi ia tidak memberikan nama khusus.[11] Penggunaan pertama istilah "amino acid" dalam bahasa Inggris tercatat dari tahun 1898,[12] sedangkan istilah Jerman, Aminosäure, telah digunakan sebelumnya.[13] Protein diketahui menghasilkan asam amino setelah pencernaan enzimatik atau hidrolisis asam dipahami. Pada tahun 1902, Emil Fischer dan Franz Hofmeister secara independen mengusulkan bahwa protein terbentuk dari banyak asam amino, dengan pembentukan ikatan di antara gugus amina dari satu asam amino dengan gugus karboksil dari asam amino lainnya, menghasilkan struktur linier yang disebut Fischer sebagai "peptida".[14]
Struktur umum
Struktur asam amino secara umum adalah satu atom karbon (C) yang mengikat empat gugus: gugus amina (–NH2), gugus karboksil (–COOH), atom hidrogen (H), dan satu gugus sisa (R dari residu) sebagai substituen organik yang dikenal sebagai rantai samping yang membedakan satu asam amino dengan asam amino lainnya.
Sesuai dengan penamaan senyawa bergugus karboksil, atom C pusat tersebut dinamai atom Cα ("C-alfa"), yaitu atom C yang berikatan langsung dengan gugus karboksil. Karena gugus amina juga terikat pada atom Cα ini, senyawa tersebut merupakan asam amino-α.[15] Asam amino biasanya diklasifikasikan berdasarkan sifat kimia rantai samping tersebut menjadi empat kelompok. Rantai samping dapat membuat asam amino bersifat asam lemah, basa lemah, hidrofilik jika polar, dan hidrofobik jika nonpolar.
Isomerisme
Karena atom C pusat mengikat empat gugus yang berbeda, maka asam amino—kecuali glisina—memiliki isomer optik: l dan d. Cara sederhana untuk mengidentifikasi isomeri ini dari gambaran dua dimensi adalah dengan "mendorong" atom H ke belakang pembaca (menjauhi pembaca). Jika searah putaran jarum jam (putaran ke kanan) terjadi urutan karboksil-residu-amina maka ini adalah tipe d. Jika urutan ini terjadi dengan arah putaran berlawanan jarum jam, maka itu adalah tipe l. (Aturan ini dikenal dalam bahasa Inggris dengan nama CORN, dari singkatan COOH - R - NH2). Hampir semua asam amino bersifat optis aktif (dapat memutar bidang cahaya terpolarisasi) kecuali glisina.
Pada umumnya, asam amino alami yang dihasilkan eukariota merupakan tipe l meskipun beberapa siput laut menghasilkan tipe d. Dinding sel bakteri banyak mengandung asam amino tipe d.
Polimerisasi asam amino
Lihat juga artikel tentang ekspresi genetik.
Protein merupakan polimer yang tersusun dari asam amino sebagai monomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA.
Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino.
Zwitter-ion
Karena asam amino memiliki gugus aktif amina dan karboksil sekaligus, zat ini dapat dianggap sebagai sekaligus asam dan basa (walaupun pH alaminya biasanya dipengaruhi oleh gugus-R yang dimiliki). Pada pH tertentu yang disebut titik isolistrik, gugus amina pada asam amino menjadi bermuatan positif (terprotonasi, –NH3+), sedangkan gugus karboksilnya menjadi bermuatan negatif (terdeprotonasi, –COO-). Titik isolistrik ini spesifik bergantung pada jenis asam aminonya. Dalam keadaan demikian, asam amino tersebut dikatakan berbentuk zwitter-ion. Zwitter-ion dapat diekstrak dari larutan asam amino sebagai struktur kristal putih yang bertitik lebur tinggi karena sifat dipolarnya. Kebanyakan asam amino bebas berada dalam bentuk zwitter-ion pada pH netral maupun pH fisiologis yang dekat netral. Karena mempunyai muatan negatif dan positif, asam amino dapat mengalami reaksi terhadap asam maupun basa.
Perubahan pH emulsi dapat mempengaruhi muatan protein. Apabila pH emulsi di atas titik isoelektrik protein, maka protein akan bermuatan negatif dan sebaliknya protein akan bermuatan positif pada pH emulsi di bawah titik isoelektrik.
Gugus R dari asam amino polar lebih larut dalam air, atau lebih hidrofilik, dibandingkan dengan asam amino nonpolar, karena golongan ini mengandung gugus fungsional yang membentuk ikatan hidrogen dengan air.
Asam amino dasar (standar)
Protein tersusun dari berbagai asam amino yang masing-masing dihubungkan dengan ikatan peptida. Meskipun demikian, pada awal pembentukannya protein hanya tersusun dari 20 asam amino yang dikenal sebagai asam amino dasar atau asam amino baku atau asam amino penyusun protein (proteinogenik). Asam-asam amino inilah yang disandi oleh DNA/RNA sebagai kode genetik. Tahapan sintesis protein terbagi menjadi dua bagian yaitu transkripsi dan translasi. Secara umum, sintesis protein berawal dari DNA, lalu pembentukan RNA, kemudian penyusunan protein (DNA > RNA > Protein). Proses perubahan molekul ini disebut juga dengan central dogma. Proses sintesis protein di tahap awal ini merupakan proses dimana terjadi penyalinan sebagian molekul DNA.
Sintesis protein dimulai dngan pencetakan ARNd oleh ADN dalam proses transkripsi yang berlangsung di dalam inti sel. ARNd yang dihasilkan kemudian bergabung dengan ribosom di sitoplasma dengan membawa asam amino yang sesuai dengan kodon. Pada tahap transkripsi, proses penyalinan sebagain DNA akan terjadi. DNA terletak di nukleus, sedangkan pembentukan protein terjadi di ribosom. Karena letaknya yang berjauhan, maka dibutuhkan RNA polimerase untuk datang ke DNA. Transkripsi berlangsung di dalam inti sel atau di dalam matriks mitokondria dan plastida. Transkripsi dapat dipicu oleh rangsangan dari luar maupun tanpa rangsangan. Pada proses tanpa rangsangan, transkripsi berlangsung terus-menerus (gen-gennya disebut gen konstitutif atau "gen pengurus rumah", house-keeping genes). Proses transkripsi berlangsung di dalam inti sel. Sedangkan Translasi berlangsung di sitoplasma, sehingga RNA harus dikeluarkan dari inti sel menuju sitoplasma. Dalam proses translasi, terjadi penerjemahan urutan kodon pada RNA-d menjadi urutan asam amino pada ribosom.
- mRNA meninggalkan DNA menuju ribosom.
- DNA melakukan transkripsi sehingga terbentuk mRNA.
- Asam amino berderet sesuai dengan kode pembentukan protein.
- tRNA menerjemahkan kodon yang dibawa mRNA.
- Protein yang terbentuk merupakan enzim yang mengatur metabolisme sel.
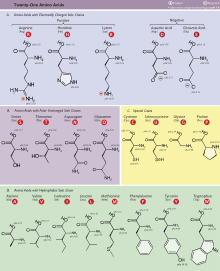
Berikut adalah ke-20 asam amino penyusun protein (singkatan dalam kurung menunjukkan singkatan tiga huruf dan satu huruf yang sering digunakan dalam kajian protein), dikelompokkan menurut sifat atau struktur kimiawinya:
Asam amino alifatik sederhana
- Glisina (Gly, G) -
- Alanina (Ala, A)
- Valina (Val, V)
- Leusina (Leu, L)
- Isoleusina (Ile, I)
Asam amino hidroksi-alifatik
Asam amino dikarboksilat (asam)
- Asam aspartat (Asp, D)
- Asam glutamat (Glu, E)
Amida
- Asparagina (Asn, N)
- Glutamina (Gln, Q)
Asam amino basa
Asam amino dengan sulfur
Prolin
- Prolina (Pro, P) (memiliki gugus siklik)
Asam amino aromatik
- Fenilalanina (Phe, F)
- Tirosina (Tyr, Y). Tirosina (bahasa Yunani: tyros, berarti keju, karena ditemukan pertama kali dari keju) (bahasa Inggris: tyrosine, 4-hydroxyphenylalanine, Tyr, Y) merupakan satu dari 20 asam amino penyusun protein. Ia memiliki satu gugus fenol (fenil dengan satu tambahan gugus hidroksil).
- Triptofan (Trp, W).
Ke-20 macam asam amino pada protein merupakan asam amino yang memiliki gugus α-karboksil, gugus α-amino, dan gugus R pada atom C-α. Kecuali pada glisin, atom C-α pada asam amino bersifat asimetris, karenanya asam amino memiliki paling tidak dua stereoisomer.
Fungsi biologi asam amino
- Penyusun protein, termasuk enzim. Asam amino-asam amino dapat berikatan satu sama lain secara kovalen dan membentuk rantai polipeptida yang panjang dan tipis. Rantai polipeptida ini kemudian bergabung dengan rantai polipeptida yang lain atau rantai non-polipeptida untuk membentuk suatu protein. Untuk membentuk peptida dan protein, asam amino akan membentuk ikatan peptida dengan molekul asam amino lainnya. Peptida terbentuk karena adanya ikatan antara amida pada gugus amina dengan gugus hidroksil pada molekul lainnya melalui proses kondensasi. Salah satu fungsi protein, yaitu membantu sistem kekebalan, serta menjadi bahan pembentukan sel dan jaringan tubuh. Protein juga berfungsi sebagai sumber energi dan membentuk berbagai enzim dan hormon. Oleh sebab itu, penting bagi kita untuk memenuhi asupan protein setiapharinya. Kekurangan asam amino esensial dapat membatasi pertumbuhan linear anak-anak. Asam amino esensial adalah asam amino yang sangat penting tetapi tubuh tidak bisa memproduksinya. Reaksi pengenalan protein diantaranya uji ninhidrin, uji biuret, uji xantoproteat dan uji belerang. Untuk menentukan mutu protein dapat diukur menggunakan skor asam amino (SAA) dengan membandingkan jumlah asam amino pembatas dan membandingkan dengan asam amino sejenis dalam campuran asam amino dan protein pembanding. Selain menggunakan skor asam amino, mutu protein juga dapat dilakukan dengan uji lain. Pengaruh denaturasi pada makanan berprotein yang ter-penting dapat menyebabkan daya larut berkurang, daya cerna bertambah dan bertambahnya kekentalan protein. Denaturasi protein dapat dilakukan dengan berbagai cara, antara lain dengan panas, pH, bahan kimia, mekanik, dan sebagainya Analisis protein dalam bahan pangan dapat dilakukan dengan dua metode yaitu metode kuantitatif dan kualitatif. Kadar protein yang ditentukan berdasarkan cara Kjeldahl disebut sebagai kadar protein kasar (crude protein) karena terikut senyawaan N bukan protein.
- Kerangka dasar sejumlah senyawa penting dalam metabolisme (terutama vitamin, hormon dan asam nukleat). Metabolisme terbagi dua yaitu Anabolisme dan Kayabolisme. Anabolisme adalah proses perubahan asam amino menjadi protein. Sedangkan katabolisme adalah proses pemecahan protein menjadi asam amino. Melalui reaksi Anabolisme, asam amino digunakan untuk membentuk protein yang akan membantu pada metabolisme karbohidrat. Dari gambar terlihat jenis-jenis asam amino yang membantu proses metabolisme glukosa untuk menghasilkan energi. Melalui reaksi katabolisme, protein dipecah menjadi asam amino. Asam amino dapat digunakan sebagai sumber energi oleh tubuh ketika diperlukan. Senyawa ini juga dapat didaur ulang untuk membuat protein baru yang diperlukan oleh tubuh. Selain memecah protein, katabolisme juga dapat memecah glikogen menjadi glukosa.Proses pemecahan protein dalam usus kecil disebut dengan proteolysis. Proteolisis dimulai saat makanan masuk ke usus kecil dan menyentuh enterokinase yang menempel di dinding usus, kerja enterokinase seperti alarm bangun untuk para enzim. Enterokinase membangunkan enzim tripsin yang tertidur dan mengaktifkannya. Kelompok reaksi yang terjadi pada tingkat sel dikenal dengan nama metabolisme perantara atau metabolisme intermediet. Asam amino akan diserap oleh sel-sel usus dan kemudian dibawa ke liver melalui aliran darah vena porta. Dari liver, asam amio akan disalurkan ke seluruh tubuh untuk dimanfaatkan. Ada beberapa lintasan metabolisme ketika reaksi kimia, terjadi perubahan pada sebuah senyawa menjadi senyawa lain melalui beberapa proses dengan difasilitasi enzim yang bersifat spesifik. Sementara itu kelebihan asam amino akan keluar dari tubuh lewat proses ekskresi atau pengeluaran ampas hasil metabolisme yang tidak dibutuhkan tubuh. Nah, hal inilah yang bisa menyebabkan peningkatan berat badan dari waktu ke waktu. Transaminasi adalah proses perubahan asam amino menjadi jenis asam amino lain. Proses transaminasi didahului oleh perubahan asam amino menjadi bentuk asam keto, secara skematik digambarkan sebagai berikut: Alanin + α-ketoglutarat ↔ piruvat + glutamat. Transaminasi terjadi pada berbagai jaringan. Deaminasi adalah suatu reaksi kimiawi pada metabolisme yang melepaskan gugus amina dari molekul senyawa asam amino. Gugus amina yang terlepas akan terkonversi menjadi amonia. Pada manusia, deaminasi terutama terjadi pada hati, walaupun asam glutamat juga mengalami deaminasi pada ginjal. Gugus amino dari kelebihan asam amino dikeluarkan dengan transaminasi atau deaminasi oksidatif, dan rangka karbonnya dikonversi menjadi perantara amfibolik. Contohnya Urea merupakan molekul dari amonia yang dibentuk pada proses deaminasi asam amino dalam hati. Denaturasi protein adalah sebuah proses di mana protein atau asam nukleat kehilangan struktur tersier dan struktur sekunder dengan penerapan beberapa tekanan eksternal atau senyawa. Terjadinya denaturasi protein dapat disebabkan oleh beberapa faktor, seperti pemanasan, pengadukan, asam atau basa dan garam. Tiap faktor tersebut memiliki pengaruh yang berbeda-beda terhadap denaturasi protein. Denaturasi terjadi akibat inkorporasi udara dan adsorpsi molekul protein ke dalam antarmuka udara-cairan. Energi untuk antarmuka udara-cairan lebih besar dibandingkan fase curah sehingga protein mengalami perubahan konformasi dipengaruhi oleh fleksibilitas protein. Denaturasi protein dapat dilakukan dengan berbagai cara, antara lain dengan panas, pH, bahan kimia, mekanik, dan sebagainya. Masing–masing cara mempunyai pengaruh yang berbeda terhadap denaturasi protein. Denaturasi protein dapat menyebabkan protein kehilangan daya mengikat terhadap air. Pada proses denaturasi terjadi pemutusan ikatan hidrogen, interaksi hidrofobik dan ikatan garam hingga molekul protein tidak punya lipatan lagi. Dalam hal ini denaturasi akan mengakibatkan adanya perubahan yang dialami protein terhadap sifat-sifatnya yaitu: (1) Daya larut berkurang, (2) Daya cerna ber- tambah karena enzim proteolitik, (3) Berkurangnya ke-lompok sulfhidril (-SH), (4) Kehilangan enzim yang di-miliki apabila protein merupakan enzim
- Pengikat ion logam penting yang diperlukan dalam reaksi enzimatik (kofaktor). Protease adalah enzim yang menghidrolisis ikatan peptida pada molekul protein yang menghasilkan peptida atau asam amino. Enzim pepsin berfungsi mengubah protein menjadi asam amino. Bila jumlah enzim pepsin kurang, proses tersebut akan terganggu dan penyerapan nutrisi dari makanan yang mengandung protein pun terhambat.
Asam amino esensial
Asam amino diperlukan oleh makhluk hidup sebagai penyusun protein atau sebagai kerangka molekul-molekul penting. Ia disebut esensial bagi suatu spesies organisme apabila spesies tersebut memerlukannya tetapi tidak mampu memproduksi sendiri atau selalu kekurangan asam amino yang bersangkutan. Untuk memenuhi kebutuhan ini, spesies itu harus memasoknya dari luar (lewat makanan). Istilah "asam amino esensial" berlaku hanya bagi organisme heterotrof.
Bagi manusia, ada delapan (ada yang menyebut sembilan) asam amino esensial yang harus dipenuhi dari diet sehari-hari, yaitu isoleusina, leusina, lisina, metionina, fenilalanina, treonina, triptofan, dan valina. Histidina dan arginina disebut sebagai "setengah esensial" karena tubuh manusia dewasa sehat mampu memenuhi kebutuhannya. Asam amino karnitina juga bersifat "setengah esensial" dan sering diberikan untuk kepentingan pengobatan.
Lihat pula
- Asam jengkolat, suatu asam amino yang menyebabkan gejala "jengkolan"
Catatan
- ^ Prolina adalah pengecualian terhadap rumus umum ini karena tidak memiliki gugus NH2 akibat siklisasi dari rantai sampingnya, asam imino; ia dikategorikan sebagai asam amino berstruktur khusus.
- ^ Contohnya, ruminansia seperti sapi mendapatkan sejumlah asam amino via mikrob di dalam dua ruangan pertama lambungnya.
Referensi
- ^ a b Parker, Sybil, P (1983). McGraw-Hill Dictionary of Biology. McGraw-Hill Company.
- ^ Vickery HB, Schmidt CL (1931). "The history of the discovery of the amino acids". Chem. Rev. 9 (2): 169–318. doi:10.1021/cr60033a001.
- ^ Hansen, Sabine (May 2015). "Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois" (PDF) (dalam bahasa Jerman). Berlin. Diarsipkan dari versi asli (PDF) tanggal 1 December 2017.
- ^ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie. 57: 88–93.
- ^ a b Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. hlm. 99, 103. ISBN 978-0-12-034226-6.
- ^ Wollaston WH (1810). "On cystic oxide, a new species of urinary calculus". Philosophical Transactions of the Royal Society. 100: 223–230. doi:10.1098/rstl.1810.0015.
- ^ Baumann E (1884). "Über cystin und cystein". Z Physiol Chem. 8 (4): 299–305. Diarsipkan dari versi asli tanggal 14 March 2011. Diakses tanggal 28 March 2011.
- ^ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique". Annales de Chimie et de Physique. 2nd Series. 13: 113–125.
- ^ Simoni RD, Hill RL, Vaughan M (September 2002). "The discovery of the amino acid threonine: the work of William C. Rose [classical article]". The Journal of Biological Chemistry. 277 (37): E25. PMID 12218068.
- ^ McCoy RH, Meyer CE, Rose WC (1935). "Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid". Journal of Biological Chemistry. 112: 283–302.
- ^ Menten, P. Dictionnaire de chimie: Une approche étymologique et historique. De Boeck, Bruxelles. link.
- ^ Harper, Douglas. "amino-". Online Etymology Dictionary. Diakses tanggal 19 July 2010.
- ^ Paal C (1894). "Ueber die Einwirkung von Phenyl‐i‐cyanat auf organische Aminosäuren". Berichte der Deutschen Chemischen Gesellschaft. 27: 974–979. doi:10.1002/cber.189402701205. Diarsipkan dari versi asli tanggal 2020-07-25.
- ^ Fruton, Joseph S. (1990). "Chapter 5- Emil Fischer and Franz Hofmeister". Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences. 191. American Philosophical Society. hlm. 163–165. ISBN 978-0-87169-191-0.
- ^ "Alpha amino acid". The Merriam-Webster.com Medical Dictionary. Merriam-Webster Inc.
- ^ Reaksi Asam Basa Terhadap Asam Amino











Comments
Post a Comment